(clique na Imagem para dar zoom)
Especial Tabela periodica - Hidrogenio

O hidrogênio possui a estrutura atômica mais simples que qualquer outro elemento químico, seu núcleo contem um próton com carga +1, com um elétron circundante e configuração eletrônica 1s¹. Os átomos de hidrogênio podem obter estabilidade de três maneiras diferentes:
Estrutura Eletrônica
- Formando uma ligação covalente (um par de elétrons) com outros átomos;
- Perdendo um elétron para formar H+;
- Adquirindo elétrons e formando H-;
Posição na tabela periódica
O hidrogênio (H) é o primeiro elemento da Tabela Periódica e apresenta características únicas.
A estrutura eletrônica do átomo de hidrogênio se assemelha com a dos metais alcalinos (Grupo 1) , com a dos halogênios e com os elementos do Grupo 14.
No caso da estrutura semelhante com metais alcalinos é devido à tendência muito maior que hidrogênio apresenta de formar ligações covalentes.
Já os halogênios geralmente adquirem elétrons formando íons negativos X-. Não é comum o hidrogênio formar um íon negativo, embora ele forme hidretos iônicos M+H- com alguns metais altamente eletropositivos, justificando sua semelhança com a estrutura eletrônica dos halogênios.
Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido.
A estrutura eletrônica do átomo de hidrogênio se assemelha com a dos metais alcalinos (Grupo 1) , com a dos halogênios e com os elementos do Grupo 14.
No caso da estrutura semelhante com metais alcalinos é devido à tendência muito maior que hidrogênio apresenta de formar ligações covalentes.
Já os halogênios geralmente adquirem elétrons formando íons negativos X-. Não é comum o hidrogênio formar um íon negativo, embora ele forme hidretos iônicos M+H- com alguns metais altamente eletropositivos, justificando sua semelhança com a estrutura eletrônica dos halogênios.
Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido.
Abundância do hidrogênio
O hidrogênio é o elemento mais abundante do universo. Segundo
avaliações, o universo é constituído por 92% de hidrogênio e 7% de
hélio, de modo que todos os demais elementos juntos representam apenas
1%. Entretanto, a quantidade de H2 na atmosfera terrestre é
muito pequena, pois o campo gravitacional da terra é pequeno demais para
reter um elemento tão leve. Apesar disso, um pouco de H2 é
encontrado nos gases vulcânicos. Em contrapartida, o hidrogênio é o
décimo elemento mais abundante da crosta terrestre (1520 ppm ou 0,152 %
em peso). Também é encontrado em grandes quantidades na águas dos
oceanos. Compostos contendo hidrogênio são muito abundantes, sobretudo a
água, organismos vivo (carboidratos e proteínas), compostos orgânicos,
combustíveis fósseis (carvão, petróleo e gás natural), amônia e ácidos.
De fato, o hidrogênio forma mais compostos que qualquer outro elemento.
Propriedades do hidrogênio molecular
O hidrogênio é um gás muito leve por sua baixa densidade e é utilizado no lugar do Hélio para inflar balões meteorológicos. É incolor, inodoro e quase insolúvel em água. O hidrogênio forma moléculas diatômica H2, onde os dois átomos estão unidos por uma ligação covalente muito forte.
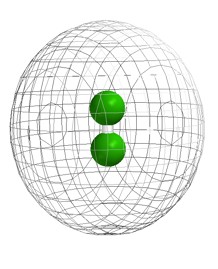
Em condições normais, o hidrogênio não é muito reativo por causa da força da ligação H-H. Em consequência, muitas reações são lentas, ou requerem elevadas temperaturas ou catalisadores (frequentemente metais de transição).
A molécula de hidrogênio é muito estável e apresenta pouca tendência de se dissociar a temperaturas normais, já que a reação de dissociação é muito endotérmica. Porém, a altas temperaturas, num arco elétrico ou sob irradiação com luz ultravioleta, o H2 se dissocia.
O hidrogênio atômico é um forte agente redutor, e é comumente preparado em solução usando um par zinco-cobre ou mercúrio-alumínio.
O hidrogênio reage diretamente com a maioria dos elementos, nas condições apropriadas.
O hidrogênio reage com os halogênios.
Diversos metais reagem com H2, formando hidretos.
Grandes quantidades de H2 são utilizadas na produção industrial de amônia.
O hidrogênio também é usado para reduzir nitrobenzeno à anilina (na indústria de corantes), e na redução catalítica do benzeno com CO para formar metanol.

Em condições normais, o hidrogênio não é muito reativo por causa da força da ligação H-H. Em consequência, muitas reações são lentas, ou requerem elevadas temperaturas ou catalisadores (frequentemente metais de transição).
A molécula de hidrogênio é muito estável e apresenta pouca tendência de se dissociar a temperaturas normais, já que a reação de dissociação é muito endotérmica. Porém, a altas temperaturas, num arco elétrico ou sob irradiação com luz ultravioleta, o H2 se dissocia.
O hidrogênio atômico é um forte agente redutor, e é comumente preparado em solução usando um par zinco-cobre ou mercúrio-alumínio.
O hidrogênio reage diretamente com a maioria dos elementos, nas condições apropriadas.
O hidrogênio reage com os halogênios.
Diversos metais reagem com H2, formando hidretos.
Grandes quantidades de H2 são utilizadas na produção industrial de amônia.
O hidrogênio também é usado para reduzir nitrobenzeno à anilina (na indústria de corantes), e na redução catalítica do benzeno com CO para formar metanol.
Isótopos de hidrogênio
Isótopos são átomos de um mesmo elemento que possuem diferentes
números de massa. A diferença nos números de massa decorre da quantidade
diferente de nêutrons no núcleo. O hidrogênio encontrado na natureza é
constituído por três isótopos: prótio 11H ou H, o deutério 21H ou D, e o trítio 31H ou T. Esses isótopos contem no núcleo 1 próton e zero, 1 ou 2 nêutrons, respectivamente. O prótio é o mais abundante.
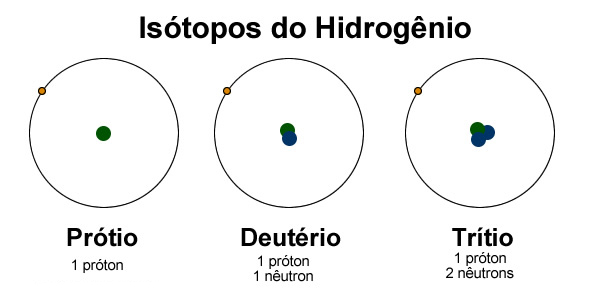
O hidrogênio encontrado na natureza contém 99,986% do isótopo 11H, 0,014% do isótopo 21H e 7 x10-16 % do isótopo 31H,de modo que as propriedades do hidrogênio são essencialmente devido ao isótopo mais leve.
Esses isótopos apresentam a mesma configuração eletrônica e essencialmente as mesmas propriedades químicas. As únicas diferenças são encontradas nas velocidades de reação e nas constantes de equilíbrio.

O hidrogênio encontrado na natureza contém 99,986% do isótopo 11H, 0,014% do isótopo 21H e 7 x10-16 % do isótopo 31H,de modo que as propriedades do hidrogênio são essencialmente devido ao isótopo mais leve.
Esses isótopos apresentam a mesma configuração eletrônica e essencialmente as mesmas propriedades químicas. As únicas diferenças são encontradas nas velocidades de reação e nas constantes de equilíbrio.
O íon hidrogênio
A energia de ionização
trata-se de uma quantidade de energia muito grande. Consequentemente,
as ligações formadas pelo hidrogênio em fase gasosa são geralmente
covalentes, O fluoreto de hidrogênio é o composto que apresenta maior
probabilidade de conter um hidrogênio iônico (H+), dado que apresenta a
maior diferença de eletronegatividades. Mas mesmo nesse caso a ligação
tem somente 45% de caráter iônico.


Nenhum comentário:
Postar um comentário